Роговой слой – от корнеобиохимии до корнеотерапии
Доктор Ганс-Ульрих Ябс (Dr. Hans-Ulrich Jabs)
Опубликовано в Эстетическая дерматология (Ästhetische Dermatologie) (mdm)) 2013 (1), p.14-19
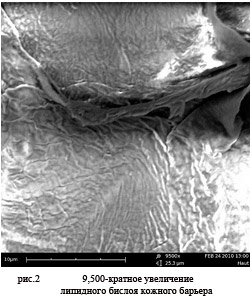
Эпидермис представляет собой динамическую систему непрерывной пролиферации и дифференциации. Он главным образом состоит из кератиноцитов, меланоцитов и иммунокомпетентных клеток. Роговой слой, верхний слой эпидермиса, имеет важнейшее значение для барьерной функции кожи. Барьер состоит из ороговевших клеток кожи (корнеоцитов), которые встроены в матрицу, состоящую из множества пластинчатых липидных слоев.
Структура и метаболизм эпидермиса имеют две основные функции: защита кожи от внешних воздействий и поддержка её увлажнения и осмотического баланса внутренних тканей. Барьерная функция кожи существенно зависит от структурной организации внеклеточного матрикса липидов рогового слоя. Нарушения барьера могут привести к кожным заболеваниям, таким как атопический дерматит, псориаз, к сухости и чувствительности кожи, а также к преждевременному старению кожи. Для того чтобы влиять на метаболизм кожи препараты по уходу за кожей должны проникать в кожный барьер. Один из подходов в развитии дерматологических косметических препаратов состоит в манипулировании липидным слоем путем проникновения в него модуляторов с целью повышения проницаемости барьерных слоев для гидрофильных веществ. После того как активные вещества достигли более глубоких слоев кожи, защитные функции барьера должны быть восстановлены с помощью правильно подобранных препаратов для местного применения.
Роговой слой
Функция кожного барьера определяется молекулярной архитектурой липидных слоев в межклеточном пространстве. В химическом отношении, барьер состоит из комбинации керамидов, насыщенных жирных кислот с длинной цепью, и холестерина в молекулярном отношении примерно 1:1:1 [1]. Сульфат холестерина и олеиновые кислоты могут присутствовать в незначительных концентрациях. Эти липиды происходят из внутриклеточных органелл зернистого слоя. Керамиды формируются из сфинголипидов (гликозильные керамиды) в ферментативном процессе. Достаточная гидратация имеет наиважнейшее значение для сбалансированного метаболизма липидов, а кислые значения рН играют важную роль для ферментативной активности. Особая роль в барьерной функции принадлежит керамидам, которые присутствуют в высокой концентрации в роговом слое. Молекулярная конфигурация липидов представлялась в различных моделях, которые, однако, не смогли объяснить все различные функции кожного барьера. Популярная учебная модель представляет барьерный слой в виде кирпичной стены, где корнеоциты – кирпичи, а липидный слой – цемент [2].
Электронно-микроскопические исследования смогли доказать, что липиды образуют пластинчатые бислои в "широкий – узкий – широкий" – последовательности, с жидкой фазой (узкий), окруженной упорядоченно расположенными липидными структурами [3-9]. Согласно данной модели, проникновение веществ через роговой слой должно происходить в жидкой фазе. Основываясь на этих данных, были разработаны теоретические модели конфигурации внеклеточного липидного матрикса. Модель Боустра (Bouwstra*) показывает узкий бислой, как взаимосвязанные длинные цепи линолевой кислоты керамида 1 (керамид EOS), сложенные короткоцепочечные керамиды и холестерин, в то время как оба широких бислоя сформированы сложенными длинноцепочечными керамидами и холестерином. Длинные цепи жирных кислот церамида1 пронизывают несколько липидных слоев, следовательно, они являются основным структурирующим компонентом. В этом контексте, обе двойные связи в ацильной боковой цепи керамида1, по-видимому, имеют особое значение. Замена линолевой кислоты олеиновой кислотой вызывает значительные нарушения в структуре и барьерной функции рогового слоя.
Инновационная модель рогового слоя Норлена
Норлен** изучил молекулярную конфигурацию липидов рогового слоя с использованием инновационных крио-электронных микроскопических исследований***. Данная технология использует различные плотности электронов в биологическом материале и, следовательно, индуцированные интерференционные эффекты для отображения мембранных структур. Исследование показывает, что кожный барьер человека характеризуется асимметричными бислоями липидов. По сравнению с моделью мембраны, была предложена двухслойная структура, которая состоит из комплексов вытянутых в цепочку керамидов, к функциональным группам которых прикреплены молекулы холестерина [10].
Эта липидная структура кожного барьера образует пластинчатый бислой. Конфигурация липидов происходит при биохимических процессах в водных условиях. Липиды выделяются из пластинчатых тел в межклеточное пространство, и через дегликозилирование и гидратацию гликозильных керамидов формируется липидный матрикс кожного барьера [11-13]. Посредством гидратации, конформация керамидов изменяется от сложенного в растянутый вид. Ликвидация остатков сахара поддерживает эти структурные изменения. В то время как гликозильные керамиды, всязывающие 5-10 молекул воды только на 1 молекулу липида, медленно изменяют свою конформацию, флип-флоп движение**** керамидов, связывающих только 0-1 молекулы воды происходит значительно быстрее [14].
Благодаря такой специфической конфигурации липидов формируется оптимально упакованная структура бислоя. Физиологическим следствием этого является липидный матрикс, который почти непроницаем для воды. Кроме того, этот защитный слой не чувствителен к потенциальному обезвоживанию и избыточному увлажнению, так как между слоями липидов нет обменной воды.
Структура липидной матрицы позволяет корнеоцитам перемещаться в барьерном слое, что объясняет эластичность рогового слоя. Между различными липидными слоями существуют только углеводородные цепи, которые позволяют горизонтальное смещение слоев относительно друг друга, что способствует эластичности. Благодаря этой уникальной структуре, тонкая гибкая мембрана довольно устойчива и непроницаема. Эта новая модель барьера объясняет нечувствительность кожи к гидратации и дегидратации, воздействию окружающей среды, сжатию и сдвижению.
Последний взгляд на ультраструктуру кожного барьера дает возможность разработки инновационных стратегий для лечения кожных заболеваний и создания более-ориентированных препаратов для защиты кожи и восстановления нарушенного барьера, а также создания трансдермальных систем транспортировки активных веществ через кожу [10]. Три различных функции системы барьер/активное вещество должны быть рассмотрены в дерматологии и косметологии:
- Активные вещества, которые действуют только на поверхности кожи, как, например, дезинфицирующие средства, репелленты, а также декоративная косметика (эпидермальные препараты).
- Составы для внешнего применения, разработанные таким образом, чтобы они проникали в кожу и действовали в более глубоких слоях кожи (эндодермальные препараты).
- Медицинские препараты и активные вещества с системными эффектами, что означает, что они попадают в организм (трансдермальные составы).
Целевое расположение препарата зависит от состояния барьерного слоя, от характеристики активного вещества (гидрофильное, липофильное, молекулярная масса, заряд, протеиновая связь), и от галеников (транспортная функция липосомов и нано-частиц).
Корнеотерапия
Корнеотерапия является инновационной концепцией для модуляции барьерной функции в целях обеспечения индивидуального лечения кожных проблем и обеспечения эффективного ухода за здоровой кожей. Термин корнеотерапия был изначально придуман профессором Альбертом Клигманом [15]. Корнеотерапия направлена на восстановление рогового слоя, улучшение функции кожного барьера и гомеостаза всей кожи. В случае нарушения барьера, вредные вещества и микроорганизмы могут достигать глубоких слоев кожи, где они могут вызвать воспаления и иммунологические реакции. Кроме того, увеличивается трансэпидермальная потеря воды, в результате чего кожа обезвоживается. Клигман создал outside-in therapy (лечение извне-внутрь) восстановление рогового слоя с помощью соответствующих препаратов наружного применения в качестве основных препаратов для дерматологического лечения. Впоследствии, воспалительные процессы в глубоких слоях кожи лечатся подходящими активными веществами. В отличие от этой концепции, он описывает обычный способ применения актуальных фармакологически активных веществ для лечения воспаления в глубоких слоях кожи, не воздействуя на барьер, как inside-out-therapy (лечение наизнанку). Исходя из того, что расстройства барьера остаются без внимания, в данном случае будет развиваться рецидив. Клинические исследования по корнеотерапии доказали, что кроме расстройств барьера, таких как атопический дерматит, на эту специфическую терапию отвечают также нарушения ороговения и дерматозы.
Кожно-косметические препараты для корнеотерапевтических применений
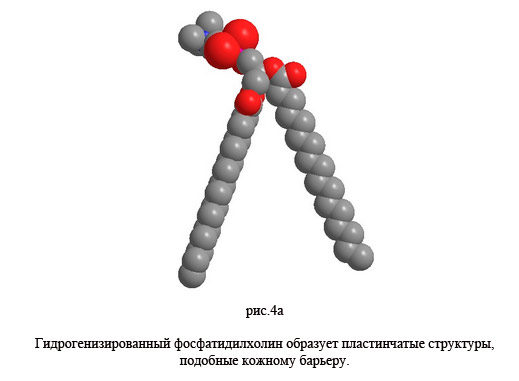
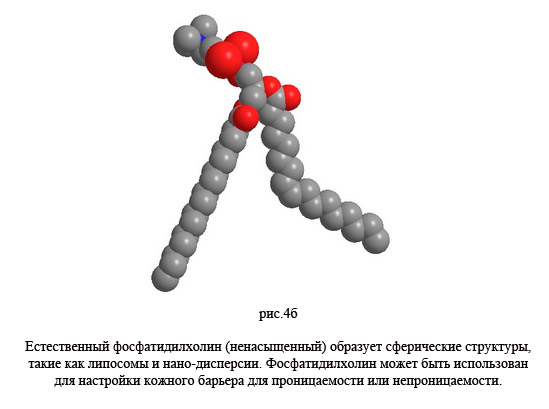
В корнеотерапии используются препараты с мембранными структурами, которые химически и физически адаптированы к условиям в роговом слое. В данном случае, наличие фосфатидилхолина оказывается одним из главных условий. Это вещество играет решающую роль как естественный компонент клеточных мембран. Кроме того, в естественной форме, фосфатидилхолин поставляет линолевую кислоту для образования керамида-1. С одной стороны, фосфатидилхолином может быть временно усилена текучесть кожного барьера. Эта особенность сравнима с процессом усиления проникновения, которое достигается липосомально-инкапсулированными активными веществами. С другой стороны, текучесть барьерных слоев может быть уменьшена гидрогенизированным фосфатидилхолином. Таким образом, фосфатидилхолин может быть использован для того, чтобы настроить кожный барьер либо на текучесть, либо на непроницаемость, т.е для очень важной особенности при практической транспортировке активных веществ, с одной стороны, и для естественной защиты кожи, с другой стороны. В гидрогенизированной форме, фосфатидилхолин используется в мембраных кремах, а в естественной форме, он используется в липосомам и наночастицах [16].
Фосфатидилхолин
Теперь возникает вопрос, как эти особенности фосфатидилхолина можно распределить в новой модели кожного барьера, упомянутой выше. Если цепи ненасыщенной жирной кислоты естественного фосфатидилхолина гидрированы, формируется молекула, сопоставимая со сложенными керамидами. Предполагается, что в случае нарушения барьера, гидрогенизированный фосфатидилхолин интегрируется вместо отсутствующих керамидов и, следовательно, восстанавливает и укрепляет барьер. По стерическим причинам достигается очень плотно упакованный липидный слой, состоящий из гидрогенизированного фосфатидилхолина, холестерина и насыщенных жирных кислот с длинной цепью. Посредством гидрирования температура фазового перехода естественного фосфатидилхолина поднимается от температуры ниже 0°C до температуры кожи. Упорядоченная гелевая фаза (Pßрасширяется и плотность упаковки увеличивается. Барьер стабилизируется и повреждения барьера устраняются.
В отличие от этого, естественная молекула фосфатидилхолина имеет изломы в остатках ненасыщенной жирной кислоты, которые увеличивают объем молекулы. Следовательно, достижима только низкая плотность упаковки, которая вызывает повышенную текучесть и большую проницаемость мембраны. Температура фазового перехода естественного фосфатидилхолина ниже 0°C. Фаза ниже основной температуры перехода называется упорядоченной, кристаллической фазой или гелевой фазой (Pß, в то время как состояние выше основной температуры (Tm) описывается как жидкая, жидкокристаллическая или неупорядоченная фаза[font=Times New Roman Greek, serif] (Lα). Этот основной переход, называемый также эндотермическим фазовым переходом, приводит к структурной модификации липидных молекул, так называемому «слиянию» цепей. Значение Tm определяется главной группой, длиной и степенью насыщенности углеводородных цепей [17]. В то время как упорядоченная фаза Pß является плотно упакованной (полная-транс-конформация углеводородных цепей), жидкокристаллическая фаза[font=Times New Roman Greek, serif] Lα имеет скошенную, нерегулярную упаковку (гош-конформация) [18]. Следующие характеристики можно наблюдать в процессе фазового перехода упорядоченной гель фазы к жидкой фазе [19]:
1.Расширение поверхности
2.Укорачивание углеводородных цепей
3.Расширение липидного бислоя
4.Быстрая латеральная диффузия
5.Сокращение Ван-дер-ваальсовых взаимодействий.
При увеличении длины цепи или насыщенности также повышается температуры фазового перехода (Tm). При температуре тела, естественный фосфатидилхолин находится в аморфной жидкокристаллической фазе. Барьерный слой разрыхляется и, следовательно, становится более проницаемым для липосомально-инкапсулированных активных веществ. Физические характеристики естественного фосфатидилхолина способствуют формированию сферических структур, таких как липосомы или нано-дисперсии, в то время как гидрогенизированный фосфатидилхолин, по термодинамическим причинам, образует пластинчатые структуры. Или, другими словами, мембранные кремы (гидрогенизированные фосфатидилхолин) стабилизируют и восстанавливают барьер, в то время как липосомы и нано-дисперсии (естественный фосфатидилхолин) ослабляют барьер и делают его более проницаемым.
Холестерин
Благодаря амфифильному характеру и жесткой конденсированной базовой структуре, холестерин показывает различные функции, такие как стабилизация и разжижение липидного бислоя [20-23]. В фосфолипидных бислоях, содержащих холестерин, вязкость уменьшается. Увеличение текучести включает в себя повышение поверхностного натяжения. Так как эта структура является энергетически неэффективной из-за увеличения поверхностного натяжения, фосфолипидные слои, содержащие холестерин, скорее образуют пластинчатые мембраные структуры, чем сферические липосомы.
Свободные жирные кислоты
Свободные жирные кислоты имеют важное значение для целостности липидного бислоя и для нормальной барьерной функции. По данным исследования Норлена, свободные жирные кислоты прикрепляются к амид-связанным ацильным цепям растянутых керамидов и таким образом формируют функциональное единство с холестерином.
Эти уникальные особенности кожного барьера привели к развитию препаратов по уходу за кожей, лечению и профилактике кожных повреждений. На основании концепции корнеотерапии, созданной профессором Клигманом, были разработаны фосфатидилхолин-содержащие мембранные кремы и липосомально и нано-частично инкапсулированные активные вещества, для того, чтобы направленно влиять на кожный барьер и настраивать его на проницаемое или непроницаемое состояние в соответствии с требуемой концепцией лечения.
Библиография
1.Wertz P et al. "Confidence Intervals" for the "true" lipid compositions of the human skin barrier? In: Forslind B, Lindberg M (eds) Skin, Hair, and Nails Structure and Function (2003). Marcel Dekker, New York, 85-106.
2. Michaels AS et al. Drug permeation through human skin. Theory and in vitro experimental measurements. AICH J.(1975) 21 (5), 985-996.
3.Breathnach AS. Aspects of epidermal structure. J. Invest. Dermatol. (1975) 65, 2-12.
4.Breathnach AS et al. Freeze fracture replication of cells of stratum corneum of human cells. J. Anat. (1973) 114, 65-81.
5.Madison KC et al. Presence of intact intercellular lamellae in the upper layers of the stratum corneum. J. Invest. Dermatol. (1987) 88, 714-718.
6.White SH et al. Structure of lamellar lipid domains and corneocyte envelopes of murine stratum corneum. An x-ray diffraction study. Biochemistry (1988) 27, 3725-32.
7.Bouwstra JA et al. Structural investigations of human stratum corneum by small-angle X-ray scattering. J. Invest. Dermatol. (1991) 97, 1005-1012.
8.Bouwstra JA et al. Structure of human stratum corneum as a function of temperature and hydration: a wide-angle x-ray diffraction study. Inter J Pharmaceut (1992) 84, 205-207.
9.Bouwstra JA. Phase behavior of stratum corneum lipid mixtures based on human ceramides: The role of natural and synthetic ceramide 1. J Invest Dermatol (2002) 118(4), 606-617.
10.Iwai I et al. The human skin barrier is organized as stacked bilayers of fully extended ceramides with cholesterol molecules associated with the ceramide shingoid moiety. J Invest Dermatol (2012), doi: 10.1038/jid. 2012.43, 1-11.
11.Caspers PJ et al. In vivo confocal raman microspectroscopy of the skin: noninvasive determination of molecular concentration profiles. J Invest Dermatol (2001) 116, 434-442.
12.Norlén L. Skin barrier formation: the membrane folding model. J Invest Dermatol (2001) 117, 823-829.
13. Al-Amoudi A et al. Nanostructure of the epidermal extracellular space as observed by cryo-electron microscopy of vitreous sections of human skin. J Invest Dermatol (2005) 124, 764-777.
14.Steck TL et al. Probing red cell membrane cholesterol movement with cyclodextrine. Biophys J (2002) 83, 2118-2125.
15.Lautenschläger H. Korneotherapie - Bindeglied zwischen Dermatologie und Kosmetologie. KOKO Kosmetikvertrieb GmbH & Co.KG, Leichlingen (2011).
16.Lautenschläger H. Geschichte und aktuelle Gesichtspunkte der Korneotherapie. Kosmetische Medizin (2005) 26 (2), 58-60.
17.Phillips MC et al. Monolayer characteristics of satured 1,2-diacyl phosphatidylcholines (lecithins) and phosphatidylethanolamines at the air/water interface. Biochim Biophys Acta (1968) 163, 301-313.
18.Winter R. Struktur und Dynamik von Modell-Biomembranen. Chemie in unserer Zeit (1990) 24, 71-81.
19.Keough KMW et al. Gel to liquid-crystalline phase transitions in water dispersions of satured mixed-acid phosphatidylcholines. Biochem (1979) 18, 1453-1461.
20.Vist M et al. Phase equilibria of cholesterol/ dipalmitoylphosphatidylcholine mixtures: 2H nuclear magnetic resonance and differential scanning calorimetry. Biochemistry (1990) 29, 451-464.
21.Smaby J et al. Phosphatidylcholine acyl unsaturation modulates the decrease in interfacial elasticity induced by cholesterol. Biophys J. (1997) 73, 1492-1505.
22.Worthman LA et al. Cholesterol in condensed and fluid phosphatidycholine monolayers studied by epifluorescence microscopy. Biophys J. (1997) 72, 2569-2580.
23.Tanaka K et al. Lipid lateral diffusion in Dilauroylphosphatidylcholine/Cholesterol mixed monolayers at the air/water interface. Langmuir (1999) 15, 600-606.
Примечания переводчика
* Д. Боустра (Joke Bouwstra, Prof. Dr.) http://www.research.leiden.edu/news/...-research.html
**Ларс Норлен (Lars Norlén), доцент дерматологии и венерологии, Институт Каролинска (Karolinska Institutet), Швеция.
*** Новейшие технологические приемы, включающие мгновенную заморозку тонких срезов кожи и последующее изучение их под низкотемпературным электронным микроскопом.
****flip-flop motion — переходить из слоя в слой (флип-флоп переход).
Любое копирование ЗАПРЕЩЕНО!









 Ответить с цитированием
Ответить с цитированием






