-
 Химический состав и антибактериальное действие эфирных масел семейства Миртовых
Химический состав и антибактериальное действие эфирных масел семейства Миртовых
Химический состав и антибактериальное действие эфирных масел семейства Миртовых
Cleber J. Silva; Luiz C. A. Barbosa; Antonio J. Demuner; Ricardo M. Montanari; Antônio L. Pinheiro; Iara Dias; Nélio J. Andrade
Введение
Развитие резистентности микроорганизмов к антибиотикам становится проблемой всемирного значения. В последние десятилетия противомикробные препараты растительного происхождения привлекли особое внимание, поскольку некоторые микроорганизмы достигли резистентности к антибиотикам.1 Среди них особое значение имеют Bacilus cereu (стафилококк), Escherichia coli (грам-отрицательные палочковидные бактерии ) и Staphylococcus aureus (золотистый стафилококк).
Следуя по пути наших предшествующих исследований биологического действия и состава летучих масел нескольких видов растений, 2 в этой работе мы сообщаем результаты, связанные с химическим составом и антибактериальным действием летучих масел семи видов Myrtaceae, выращиваемых в Бразилии.
Эксперимент
Эфирные масла видов Melaleucahypericifolia C. Sm. (Мелалеука зверобойнолистная), M. Thymifolia (Мелалеука тимьянолистная – разновидность чайного дерева) Sm., M. linariifolia Sm. (Мелалеука льнянколистная – разновидность чайного дерева), Callistemonpolandii F. M. Bailey, C. citrinus (Curtis) Skeels,C. viminalis Sol. ex Gartn. and Kunzeaericoides (Канука) (A. Rich.) J. Thompson были трижды подвергнуты газовой хроматографии и масс-спектрометрии (GC-MS). Для определения их антимикробного действия применялся метод дисков.3 Позитивный и негативный контроль роста были включены в каждый эксперимент. Антибиотики ванкомицин (30 μg), пенициллин G (10 UI), эритромицин (15 μg), гентамицин (10 μg), стрептомицин (10 μg) служили позитивным фактором контроля, а стерильная вода – негативным.
Чтобы определить минимальную ингибирующую концентрацию (MIC) и минимальную бактерицидную концентрацию (MIC) 4, был использован метод микроразведений питательного бульона. Рост бактерий определялся через помутнение. MIC был принят как минимальная концентрация эфирного масла, при которой тестируемый микроорганизм не демонстрирует видимого роста.
Чтобы определить MBC, 100 μL бульона были инокулированы в агар Мюллера-Хинтона на 24 часа при 30 или 37 ºC. MBC определяется наименьшей концентрацией эфирного масла, при которой 99.99% или более изначального инокулята погибли.
Результаты и дискуссия
Гидродистилляция свежих листьев видов Myrtaceae дала следующий выход летучих масел, исходя из сухого веса: Melaleucathymifolia 4.0%±0.01; M. hypericifolia 3.8%±0.20; M. Linariifolia 1.4%±0.02; Callistemonpolandii 0.2%±0.00; C. citrinus 1.1%±0.06; C. viminalis 0.3±0.00% and Kunzeaericoides 0.5%±0.07.
Химический состав летучих масел, произведенных одним из семи изучаемых видов, представлен в Таблице I.
Таблица 1. Химические составляющие эфирных масел из видов Myrtaceae
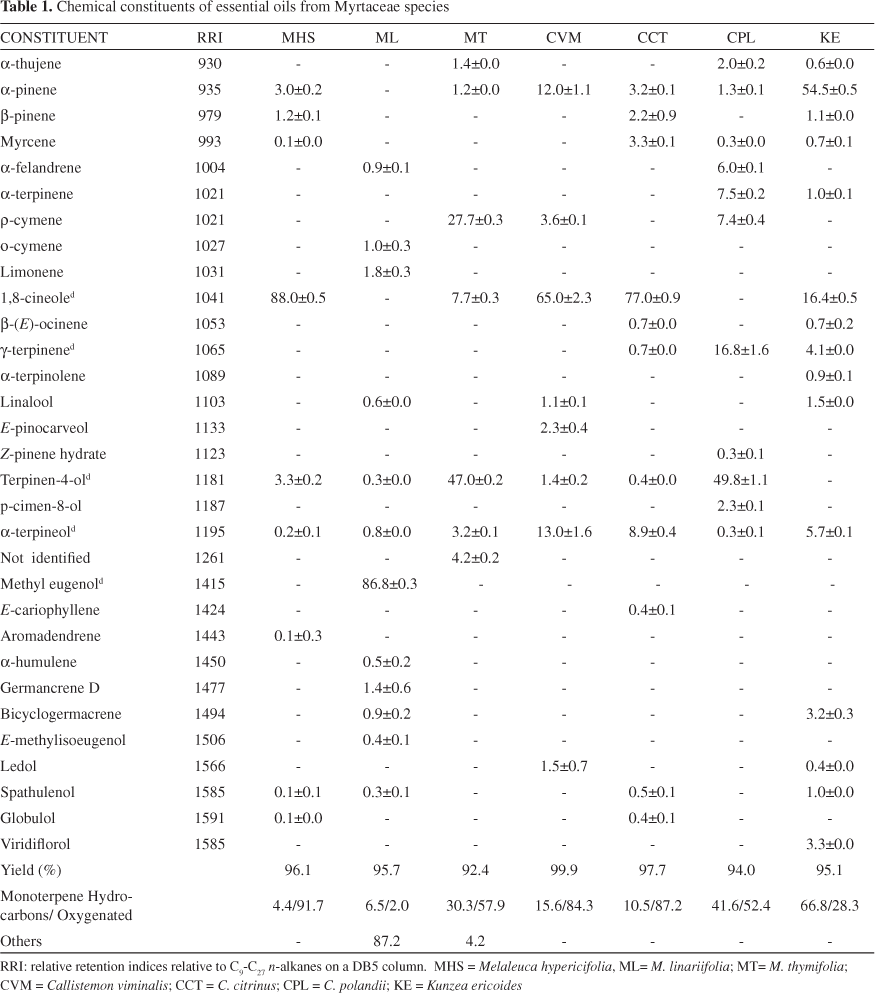
Эфирные масла K. ericoides демонстрируют большую долю монотерпенов (66.8%), имея главным компонентом α-pinene (54.5%). Масла Melaleuca и Callistemon состоят в большей части из окисленных монотерпеноидов. Однако, летучее масло M. linariifolia имеет высокую концентрацию метилэвгенола (86.8%) и следы E-methylisoeugenol (0.4%). Эфирные масла M. hypericifolia, C. viminalis и C. сitrinus отличаются большим содержанием 1,8-cineole (88.0, 65.0 и 77.0% соответственно). Кроме инсектицидных свойств, эта составляющая также оказывает антивоспалительное действие, связанное со способностью замедлять пути обмена циклооксигеназы, предотвращая биосинтез простаноидов. 5
Основным компонентом эфирных масел M. thymifolia и C. polandiiоказался terpinen-4-ol (47.0 и 49.8% соотвественно). Terpinen-4-ol – один из основных компонентов масла чайного дерева, получаемого паровой дистилляцией из M. alternifolia. Главный компонент масла Kunzea ericoides – α-pinene (54.5%) – используется как прекурсор при изготовлении синтетических репеллентов6 с низкой токсичностью для людей.
Оценка антибактериального действия по методу дисков показала, что летучие масла, выделенные из семи изучаемых видов, демонстрируют различные уровни антибактериального действия (Таблица II). В целом, эти масла менее действенны по сравнению с большинством антибиотиков. Масло M. thymifolia оказалось самым действенным против всех бактерий. Оно действеннее против золотистого стафилококкока, чем гентамицин и стрептомицин. Антибактериальное действие этого масла было оценено minimal inhibitory concentration (MIC) and minimum bactericidal concentration (MBC). Результаты представлены в Таблице III.
Таблица 2. Антибактериальное действие эфирных масел из видов Myrtaceae
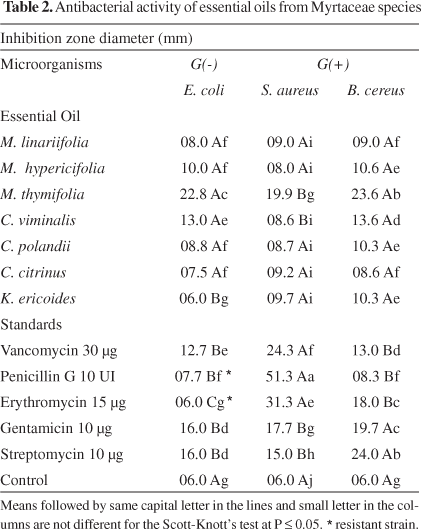
Таблица 3. Данные по минимальной ингибирующей концентрации и минимальной бактерицидной концентрации (% v/v), полученные методом микроразведений на примере эфирного масла M. myrtifolia
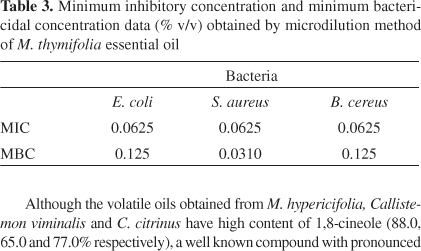
Хотя летучие масла, полученные из M. hypericifolia, Callistemon viminalis и C. citrinus имеют высокое содержание 1,8-cineole (88.0, 65.0 и 77.0% соответственно), хорошо известного соединения с антимикробными свойствами, эфирные масла этих видов показали низкую активность. Подобным образом, масла K. ericoides, в основном состоящие из монотерпеновых углеводородов (основной компонент - α-pinene (54.5%)), оказали очень слабое антибактериальное действие. α-Pinene, кажется, способен нарушать целостность клеток и вызывает угнетение дыхания и процесса переноса ионов. 7 Cerqueira и др.8 изучали масло Myrciamyrtifolia (Myrtaceae), содержащее 87.3% α-pinene и оказавшее сильное действие против S. aureus, метицилинрезистентного S. aureus и C. albicans. Некоторые исследователи заключили, что сами эфирные масла имеют более сильное антибактериальное действие, чем смесь их основных компонентов,9 что указывает на то, что второстепенные компоненты критичны для этой действенности, и могут оказывать синергетический эффект или потенцирующее влияние. Кроме того, способ действия эфирного масла, возможно, зависит, от бактериального штамма. Также стоит отметить, что синергичные и/или антагонистические эффекты могут быть приняты во внимание при наблюдении активности в сложных смесях, таких как эфирные масла.10
Основным компонентом эфирных масел из M. thymifolia и C. polandii оказался terpinen-4-ol (47.0 и 49.8% соответственно), но M. thymifolia продемонстрировала лучшую активность. Масло M. thymifolia содержало лишь один компонент, отсутствующий в масле C. polandii (1,8-cineol 7.7%), и p-cymene в большей концентрации (27.7%) (см. Таблицу I). p-Cymene это биологический прекурсор карвакрола и имеет гидрофобные свойства. Это соединение вызывает разбухание цитоплазматической мембраны в большей мере, чем карвакрол.11 Но p-Cymene не эффективен как антибактериальное средство, когда он используется отдельно .12 В комбинации с карвакролом, наблюдается синергизм.13
В заключение, описанные результаты демонстрируют многообещающие перспективы применения эфирного масла из M. thymifolia как альтернативу некоторым антибиотикам против Gram (+) и Gram (-) бактерий.
Перевод: С.Соболевский
Ссылки:
1. Essawi, T.; Srour, M.; J. Ethnopharmacol. 2000, 70, 343.
2. Martins, E. R.; Casali, V. W. D.; Barbosa, L. C. A.; Carazza, F.; J. Braz. Chem. Soc. 1997, 8, 29; Barbosa F. D. F.; Barbosa, L. C. A.; Melo, E. C.; Botelho, F. M.; Quim. Nova 2006, 29, 122; Martins, F. T.; Santos, M. H.; Pólo, M.; Barbosa, L. C. A.; Quim. Nova 2006, 29, 1203; Castro, H. G.; Oliveira, L. O.; Barbosa, L. C. A.; Ferreira, F. A.; Silva, D. J. L.; Mosquim, P. R.; Nascimento, E. A.; Quim. Nova 2004, 27, 55; Barbosa, L. C. A.; Demuner, A. J.; Teixeira, R. R.; Madruga, M. S.; Fitoterapia 1999, 70, 152; Barbosa, L. C. A.; Paula, V. F.; Azevedo, A. S.; Silva, E. M. M.; Nascimento, E. A.; Flavour Frag. J. 2005, 20, 39; Silva, A. F.; Barbosa, L. C. A.; Nascimento, E.; Casali, V. W. D.; J. Essent. Oil Res. 2000, 12, 725; Fonsceca, M. C. M.; Barbosa, L. C. A.; Nascimento, E. A.; Casali, V. W. D.; J. Essent. Oil Res. 2006, 18, 345.
3. National Committee for Clinical Laboratory Standards; Performance standards for antimicrobial susceptibility test. Ninth International Supplement, M100-S9, NCCLS: Wayne, 1997.
4. National Committee for Clinical Laboratory Standards; Performance standards for antimicrobial susceptibility test. Ninth International Supplement. M100-S9, Wayne, PA. 1999; Carson, C. F.; Hammer, K. A.; Riley, T.V.; Microbios 1995, 82, 181.
5. Dewhirst, F. E.; Prostaglandins 1980, 20, 209.
6. Wang, Z.; Song. J.; Chen, J.; Song, Z.; Shang, S.; Jiangd, Z.; Han, Z.; Bioorg. Medic. Chem. Lett. 2008, 18, 2854.
7. Sikkema, J.; de Bont, J. A. M.; Poolman, B.; J. Biol. Chem. 1994, 269, 8022; Cox, S. D.; Mann, C. M.; Karkham, J. L.; Bell, H. C.; Gustafson, J. E.; Warmington, J. R.; Wyllie, S. G.; J. Appl. Microbiol. 2000, 88, 170.
8. Cerqueira, M. D.; Souza-Neta, L. C.; Passos, M. G. V. M.; Lima, E. O.; Roque, N. F.; Martins, D.; Guedes, M. L. S.; Cruz, F. G.; J. Braz. Chem. Soc. 2007, 18, 998.
9. Gill, A. O.; Delaquis, P.; Russo, P.; Holley, R. A.; Int. J. Food Microbiol. 2002, 73, 83; Mourey, A.; Canillac, N.; Food Control 2002, 13, 289.
10. Kelen, M.; Tepe, B.; Bioresour. Technol. 2008, 99, 4096.
11. Ultee, A.; Bennink, M. H. J.; Moezelaar, R.; Appl. Environ. Microbiol. 2002, 68, 1561.
12. Juven, B. J.; Kanner, J.; Schved, F.; Weisslowicz, H.; J. Appl. Bacteriol. 1994, 76, 626; Dorman, H. J. D.; Deans, S. G.; J. Appl. Bacteriol. 2000, 88, 308; Juliano, C.; Mattana, A.; Usai, M.; J. Essential Oil Res. 2000, 12, 516.
13. Ultee, A.; Kets, E. P. W.; Alberda, M.; Hoekstra, F. A.; Smid, E. J.; Arch. Microbiol. 2000, 174, 233.
http://www.scielo.br/scielo.php?pid=...pt=sci_arttext
Любое копирование ЗАПРЕЩЕНО!
Собака лает, караван идет.
Я взрослый, состоявшийся человек. Я хочу купить себе этот радиоуправляемый вертолет! 
 Ваши права
Ваши права
- Вы не можете создавать новые темы
- Вы не можете отвечать в темах
- Вы не можете прикреплять вложения
- Вы не можете редактировать свои сообщения
-
Правила форума












 Ответить с цитированием
Ответить с цитированием



