-
 Обнаружение мелатонина в извлечениях из Пиретрума, Фиалки и др.
Обнаружение мелатонина в извлечениях из Пиретрума, Фиалки и др.
Обнаружение мелатонина в извлечениях Tanacetum parthenium, Tripleurospermum disciforme и Viola odorata
Ansari M., Rafiee Kh., Yasa N., Vardasbi S., Naimi S.M., Nowrouzi A.
ВВЕДЕНИЕ
Мелатонин – это индоламин, выделяемый шишковидной железой у млекопитающих (1). Эта молекула связана с рядом физиологических и патофизиологических функций, включая регулирование циркадных ритмов (1), предупреждение ишемии - реперфузионных нарушений (2), облегчение хронических болей (3), повышение иммунитета (4), онкостатические эффекты (5), лечение неврологических расстройств, таких как мигрень (6), антибактериальная активность (7), противовоспалительные и антиоксидантные свойства (8).
Несколько исследований в последнее десятилетие выявили мелатонин в различных частях растений и открыли новую главу в области извлечения мелатонина из растений (фитомелатонин) (9). Большинство трав, которые содержат большое количество мелатонина, традиционно используются для лечения неврологических расстройств (10) или заболеваний, связанных с генерацией свободных радикалов (11), что может быть связано с наличием этой мощной антиоксидантной молекулы.
Пиретрум девичий - Tanacetum parthenium (L.) Schultz. Bip. (Asteraceae), Трёхрёберник дисковидный - Tripleurospermum disciforme (C.A. Mey) Schultz. Bip. (Asteraceae) и Фиалка - Viola odorata (L.) (Violaceae), которые были оценены в настоящем исследовании, имеют долгую историю в иранской традиционной медицине для лечения мигрени (12), рака (13) и менструальных болей (12, 14), а также использовались в качестве седативных (15,16), антимикробных (17,18), противовоспалительных средств (12,13,15,19), и при других общих проблемах, связанных со стрессом (14,18). Из-за известной биологической активности мелатонина при различных заболеваниях, была выдвинута гипотеза, что в дополнение к другим активным ингредиентам, данные растения могут также содержать мелатонин. Употребление водного экстракта или отвара различных частей растений – наиболее распространенный способ использования лекарственных растений в домашних хозяйствах и в традиционной медицине (20). Так как ни в одном исследовании до сих пор не сравнивалось содержание мелатонина в отварах и спиртовых экстрактах, в настоящем исследовании была сделана попытка решения этих вопросов.
РЕЗУЛЬТАТЫ И ДИСКУССИЯ
Мелатонин был выявлен в экстрактах трав в настоящем исследовании. Исследование контроля качества показало, что выход мелатонина был около 80%, что может бы стать средством для расчета относительного содержания мелатонина в образцах до гомогенизации и экстракции растворителями. После коррекции значений по уровню выхода, концентрации мелатонина были рассчитаны для цветов растений с помощью методов ВЭЖХ-УФ и ИФА (Таблица 1).
Таблица 1. Содержание мелатонина в трех медицинских травах, определенное методами ВЭЖХ-УФ и ИФА
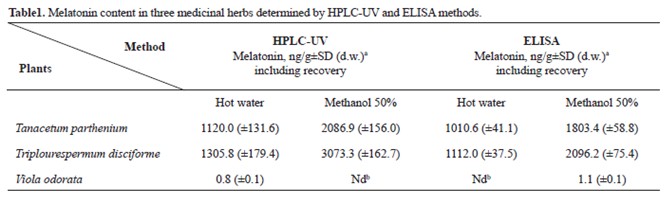
a Концентрация метаболита, выраженная в граммах сухого вещества
b Мелатонин был ниже предела обнаружения
В цветках Т. parthenium высокие концентрации мелатонина наблюдались при всех методах экстракции; результат отличается от данных March и др. (10), которые показывают очень высокие концентрации мелатонина в листьях этого растения, но не в их цветках. Переменные, такие как внутри-видовые различия, ложно-положительное обнаружение, разрушение при процедуре экстракции (23), и экологические факторы, такие как качество почвы, температура и экологический стресс (27), влияют на уровень мелатонина в растениях и могут быть причиной такого различия.
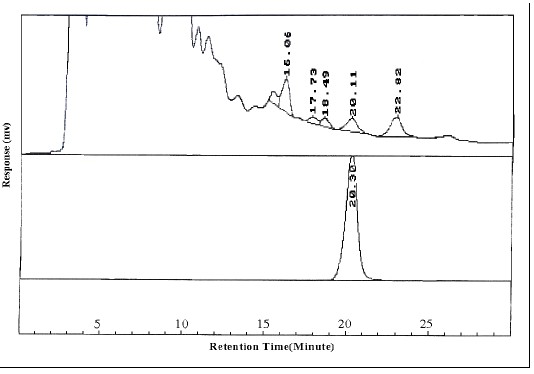
Значения мелатонина в водных и спиртовых экстрактах T. Disciforme были значительно выше по методам ИФА и ВЭЖХ по сравнению с другими двумя растениями (р <0,001) (табл. 1). Ранее, высокий уровень мелатонина был зарегистрирован у некоторых лекарственных растений, таких как Шиянский чайный лист, Chantui (11), и пиретрум (10). Не удалось обнаружить значительное количество мелатонина в цветках V. odorata при ВЭЖХ, но низкий уровень был найден в той же пробе методом ИФА (табл. 1). ВЭЖХ хроматограммы экстракта, полученного из Т. parthenium с синтетическим мелатонином, показаны на рисунке 2.
Рисунок 2. Пики ВЭЖХ-УФ для экстракта Т. parthenium,вверху, (Rt= 20.1 мин) в сравнении со стандартом для мелатонина, внизу, (Rt= 20.3 мин), при длине волны 280 нм. Подвижная фаза состояла из 0,1 М калий-фосфатного буфера (рН 4,5) с ацетонитрилом (20%) при flow rate 1 мл / мин.
Средние показатели уровня мелатонина в цветках растений, полученные методом ВЭЖХ, существенно отличаются от значений, полученных методом ИФА (Р <0,001) (табл. 1). Например, в случае V. odorata можно было обнаружить мелатонин методом ИФА, но не с помощью метода ВЭЖХ (чувствительность; ВЭЖХ = 20ng, ИФА = 0,2 пг). В других случаях, ВЭЖХ, а не методом ИФА, обнаружены высокие уровни мелатонина в T. parthenium и T. disciforme. Что касается растительного происхождения индоламинов (28) и их возможной коэлюции с мелатонином (23), метод ВЭЖХ дал ложно-положительные результаты. Интересно, что фракции, полученные от ВЭЖХ и использованные в методе ТСХ, показали другие компоненты с отличными значениями Rf. Еще одной причиной для различных значений ВЭЖХ и ИФА может быть возможное разрушение мелатонина в ИФА за время, необходимое для подготовки образца.
Для идентификации фитомелатонина был применен ТСХ. Для каждого растительного образца, цвет продукта конденсации indole был сравнен на глаз со стандартом (который был голубоватым). Значение Rf концентрата было 0,72, что согласуется со значением для синтетического мелатонина (данные не приведены). TLC может создать проблемы в связи с наличием многочисленных соединений индоламина в растительных образцах (28), которые могут быть обнаружены по методу Van Urk-Salkowski (26). ВЭЖХ-очистка перед ТСХ устранила эти проблемы, а также подтвердила, что образец, полученный посредством ВЭЖХ – это мелатонин.
Результаты этого изыскания показывают, что водяная фракция, полученная выпариванием или отвариванием цветков растений, содержит значительное количество мелатонина (табл. 1). Хотя большая доля мелатонина может быть освобождена с помощью горячей воды, использование метанола может повысить эффективность экстрагирования (р <0,001) за счет увеличения растворимости (21), наибольшее количество мелатонина было получено с помощью 1 : 1 смеси метанола и воды. Конечно, эта разница может возникнуть в результате возможного разрушения молекул из-за жара. Сообщалось, что уровень этого индоламина в не-термообработанных продуктах питания значительно выше, чем в термообработанных продуктах (25).
Исследования с людьми показали, что потребление овощей приводит к экскреции в моче 6-sulfatoxy мелатонина (29); вероятно, это связано с повышением уровня мелатонина в плазме крови, вызванного этими овощами. Многие исследования подтверждают, что нормальный пиковый уровень мелатонина в сыворотке крови человека составляет 10-200 пикограмм / мл (1). Поскольку лекарственные травы настоящего исследования содержат мелатонин в концентрации от 0,8 - 3000 нг / г, это может быть отличный диетический источник мелатонина для дополнения эндогенно синтезированного мелатонина. Кроме того, мелатонин может быть молекулой, ответственной за фармакологические свойства этих растений.
ВЫВОДЫ
Фракция, выделенная с помощью горячей воды из цветков T. parthenium, T. disciforme и V. Odorata, содержала значительное количество мелатонина. Однако, гидро-спиртовой раствор позволил извлечь больше мелатонина из цветков растений. Наличие мелатонина в этих растительных тканях может обеспечить какое-то объяснение анекдотических известиям об их физиологическом воздействии на человека. Эти травы должны быть пересмотрены в связи с их питательной и целебной ценностью и возможностью их применения в случае других болезней, сочетающихся с мелатонином.
Литература
1. Pandi-Perumal SR, Srinivasan V, Maestroni GJM, Cardinali DP, Poeggeler B, Hardeland R. Melatonin: 1. Nature’s most versatile biological signal? FEBS Journal, 2006; 273: 2813-2838.
2. Pasbakhsh P, Saeednia S, Abolhassani F, Ghazi Khansari M, Mehrannia K, Sobhani AG. Melatonin 2. prevents ischemia – reperfusion injury following superior mesenteric artery occlusion in the rat. DARU, 2008; 16: 95-101.
3. Blackburn-Munro G, Blackburn-Munro R. Pain in the brain: are hormones to blame?. Trends in 3. Endocrinology and Metabolism, 2003; 14: 20-27.
4. Carrillo-Vico A, Guerrero JM, Lardone PJ, Reiter RJ. A review of the multiple actions of melatonin on the 4. immune system. Endocrine, 2005; 27: 189-200.
5. Jung B, Ahmad N. Melatonin in cancer management: progress and promise. Cancer Research, 2006; 66: 5. 9789-9793.
6. Peres MFP, Masruha MR, Zukerman E, Alberto C, Moreira-Filho & Cavalheiro EA. Potential therapeutic 6. use of melatonin in migraine and other headache disorders. Expert Opinion on Investigational Drugs, 2006; 15: 367-375.
7. Tekbas OF, Ogur R, Korkmaz A, Kilic A, Reiter RJ. Melatonin as an antibiotic: new insights into the 7. actions of this ubiquitous molecule. Journal of Pineal Research, 2008; 44: 222-226.
8. Tan DX, Manchester LC, Terron MP, Flores LJ, Reiter RJ. One molecule, many derivatives: a never-8. ending interaction of melatonin with reactive oxygen and nitrogen species?. Journal of Pineal Research, 2007; 42: 28-42.
9. Reiter RJ, Tan DX, Manchester LC, Simopoulos AP, Maldonado MD, Flores LJ, Terron MP. Melatonin 9. in edible plants (phytomelatonin): Identification, concentrations, bioavailability and proposed functions. World Review of Nutrition and Dietetics, 2007; 97: 211-230.
10. Murch SJ, Simmons CB, Saxena PK. Melatonin in feverfew and other medicinal plants. Lancet, 1997; 350: 10. 1598-1599.
11. Chen G, Huo Y, Tan DX, Liang Z, Zhang W, Zhang Y. Melatonin in Chinese medicinal herbs. Life Science, 11. 2003; 73: 19-26.
12. Mirjalili MH, Salehi P, Sonboli A, Mohammadi Vala M. Essential oil composition of feverfew (Tanacetum 12. parthenium) in wild and cultivated populations from Iran. Chemistry of Natural Compounds, 2007; 43: 181-182.
13. Koochek MH, Pipelzadeh MH, Mardani H. The Effectiveness of Viola odorata in the Prevention and 13. Treatment of Formalin-Induced Lung Damage in the Rat. Journal of Herbs, Spices & Medicinal Plants, 2002; 10: 95-103.
14. Avallone R, Zanoli P. Pharmacological profile of apigenin, a flavonoid isolated from Matricaria chamomilla. 14. Biochemical Pharmacology, 2000; 59: 1387-1394.
15. Besharati-Seidani A, Jabbari A, Yamini Y, Saharkhiz MJ. Rapid extraction and analysis of volatile organic 15. compounds of Iranian feverfew (Tanacetum parthenium) using headspace solvent microextraction (HSME), and gas chromatography/mass spectrometry. Flavour and Fragrance Journal, 2006; 21: 502-509.
16. Parvini S, Hosseini M, Bakhtiarian A. The Study of Analgesic Effects and Acute Toxicity of 16. Tripleurospermum disciforme in Rats by Formalin Test. Toxicology Mechanisms and Methods, 2007; 17: 575-580.
17. Lesley B. HERBS. In: Dorling Kindersley. (Ed.), III ed. London. 1994; 171, 197.17.
18. Fidler P, Loprinzi CL, O’Fallon JR, Leitch JM, Lee JK, Hayes DL, Novotny P, Clemens-Schutjer D, Bartel 18. J, Michalak JC. Prospective evaluation of a chamomile mouthwash for prevention of 5-FU-induced oral mucositis. Cancer, 1996; 77: 522-525.
19. Minaiyan M, Ghassemi-Dehkordi N, Mohammadzadeh B. Anti-ulcer effect of Tripleurospermum 19. disciforme (C.A. Mey) Shultz Bip on pylorus ligated (Shay) rats. Reasearch in Pharmaceutical Sciences, 2006; 1: 15-21.
20. Amin G. Popular Medicinal Plants of Iran, vol I. Research Deputy, Ministry of Health, Treatment and Medical Education, Tehran. 1991; 177-183.
21. Lemaire PA, Adosraku RK. An HPLC method for the direct assay of the serotonin precursor, 21. 5-hydroxytrophan, in seeds of Griffonia simplicifolia. Phytochemical Analysis, 2002; 13: 333-337.
22. Jang MH, Kim H, Shin MC, Lim BV, Lee TH, Jung SB, Kim CJ, Kim EH. Administration of Folium mori 22. extract decreases nitric oxide synthase expression in the hypothalamus of streptozotocin-induced diabetic rats. The Japanese Journal of Pharmacology, 2002; 90: 189-192.
23. Pape C, Luning K. Quantification of melatonin in phototrophic organisms.” Journal of Pineal Research, 23. 2006; 41: 157-165.
24. Wakabayashi H, Shimada K, Aizawa Y. Determination of serotonin and melatonin in rat pineal gland by 24. high-performance liquid chromatography with ultraviolet and fluorometric dual detection. Chem Pharm Bull (Tokyo), 1985; 33: 3875-3880.
25. De la Puerta C, Carrascosa-Salmoral MP, García-Luna PP, Lardone PJ, Herrera JL, Fernández-Montesinos 25. R, Guerrero JM, Pozo D. Melatonin is a phytochemical in olive oil. Food Chemistry, 2007; 104: 609-612.
26. Ehmann A. The van urk-Salkowski reagent--a sensitive and specific chromogenic reagent for silica gel 26. thin-layer chromatographic detection and identification of indole derivatives. Journal of Chromatography, 1977; 132: 267-276.
27. Reiter RJ, Tan DX, Burkhardt S, Manchester LC. Melatonin in plants. Nutrition Review, 2001; 59: 286-290.27.
28. Badria F. Melatonin, serotonin and tryptamine in some Egyptian food and medicinal plants. Journal of 28. Medicinal Food, 2002; 5: 153-157.
29. Oba S, Nakamura K, Sahashi Y, Hattori A, Nagata C. Consumption of vegetables alters morning urinary 29. 6-sulfatoxymelatonin concentration. Journal of Pineal Research, 2008; 45: 17-23.
Перевод – С.Соболевский
Источник:
Любое копирование ЗАПРЕЩЕНО!
Собака лает, караван идет.
Я взрослый, состоявшийся человек. Я хочу купить себе этот радиоуправляемый вертолет! 
 Ваши права
Ваши права
- Вы не можете создавать новые темы
- Вы не можете отвечать в темах
- Вы не можете прикреплять вложения
- Вы не можете редактировать свои сообщения
-
Правила форума









 Ответить с цитированием
Ответить с цитированием



