Антибактериальная активность паров эфирных масел и их основных компонентов против патогенов респираторного тракта
Ш. Инойе, Т. Такизава, Х. Ямагучи
Резюме
Исследовали антибактериальную активность паров 14 эфирных масел и их основных компонентов против палочки инфлюэнцыHaemophilusinfluenza,пневмококка Streptococcuspneumoniae, β-гемолитического стрептококка серогруппы А Streptococcuspyogenesизолотистого стрептококка Staphylococcusaureus. Чувствительность H. influenzaeк большинству исследованных масел была наиболее высока, ниже уS. pneumoniaeиS. pyogenes, еще ниже уS. aureus. Восприимчивые и устойчивые к пенициллину штаммы S. pneumoniaeпо чувствительности не различались.Чувствительно� �ть кишечной палочки Escherichiacoli, использованной в качестве контроля, была наименьшей. Единицей активности масел и их компонентов в газовой фазе считали минимальную ингибирующую концентрацию (МИК). Самая низкая МИК (соответственно самая высокая активность) из 14 эфирных масел была у масла коры коричного дерева, лемонграсса и тимьяна, выше у эфирных масел, содержащих терпеновые спирты в качестве основных составляющих. Эфирные масла, содержащие терпеновый кетон, эфиры, в частности, углеводороды, имели высокую МИК. Активность в газовой фазе при короткой экспозиции была сравнимой с таковой при воздействии в течении ночи, и быстрое испарение эфирных масел было более эффективным, чем медленное. Концентрация эфирных масел в парах и их абсорбция в агар достигала максимума через 1 или 2 ч после быстрого испарения. Результаты свидетельствуют, что антибактериальное действие эфирных масел наиболее эффективно при высокой концентрации в парах в течение короткого времени.
Введение
Эфирные масла растений традиционно использовали для лечения инфекций респираторного тракта и сейчас используют как рецептурные средства при простуде (1, 2). В медицине ингаляции эфирных масел используют при терапии острого и хронического бронхита, а также хронического синусита. Ингаляции эфирных масел уменьшают выделение мокроты (3), улучшают вентиляцию и дренаж носовых пазух (4), оказывают антивоспалительное действие на трахею (5) и уменьшают проявления астмы (6).
Известно, что эфирные масла обладают антимикробной активностью, которую, как правило, исследуют в жидких средах. Систематическая оценка действия паров масел впервые была проведена Maruzzella и др. (7, 8)и Kienholz (9) in 1959 году по методу инвертированных чашек Петри. Этот метод, в котором летучее соединение помещали на чашку или бумажный диск и подвергали его воздействию на расстоянии около 5 мм перевернутую пластинку агаровой среды, инокулированную исследуемыми штаммами, оказался удобным и был затем использован другими учеными (10, 11).В этих исследованиях объем воздушного пространства был слишком мал, чтобы измерить концентрацию паров эфирных масел. Мы использовали герметичный контейнер объемом 1 л для исследования паров масел (12, 13). Хотя было опубликовано исследование действия масла коры коричного дерева на микозы респираторного тракта (14), исследований действия испарений эфирных масел на основные бактериальные патогены респираторного тракта еще не было проведено.
В отличие от антибиотиков, эфирные масла являются очень летучими при комнатной температуре. Поэтому мы исследовали возможность применения этих масел в ингаляционной терапии и определяли их антибактериальную активность против пяти патогенов:Haemophilusinfluenzae, восприимчивых и устойчивых к пенициллину штаммов Streptococcuspneumoniae,StreptococcuspyogenesиStaphylococcusaureus посредством их контакта с парами масел в герметичном контейнере.В качестве контроляиспользовалиEscherichiacoli.
Материалы и методы
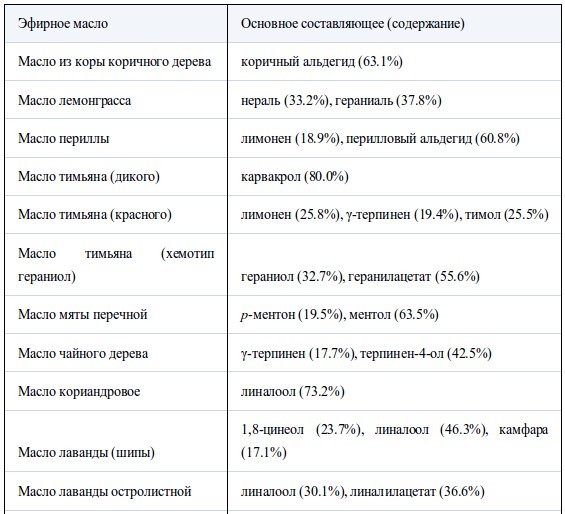
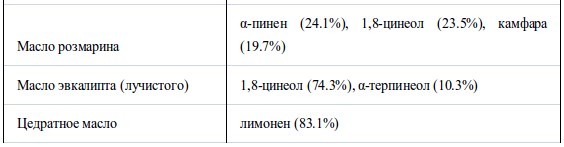
В таблице I перечислены использованные эфирные масла и их основные компоненты. Высокое качество химикатов (чистота>95%) было подтверждено газохроматографическим (ГХ) анализом. Были использованы штаммыH. influenzae ATCC 33391 иS. pyogenes ATCC 12344, а также чувствительный к пенициллину штаммS. pneumoniae IP-692, устойчивый к пенициллину штамм S. pneumoniae PRC-53,штаммы S. aureus FDA 209PJC-1 иE. coli NIHJJC-2. Агар Мюллера-Хинтона (МХА) был использован как основная среда и использовался для роста S. aureusиE. coli. МХА, содержащий 5% дефибринированную конскую кровь (шоколадный агар) и МХА, содержащий 5% дефибринированную баранью кровь (кровяной агар), были использованы для H. influenzaeи стрептококков, соответственно.
Испытуемые штаммы суспендировали в обезжиренном молоке и выдерживали при -45 ° С до использования. H. influenzae ATCC 33391 выращивали на шоколадном агаре и инкубировали в течение ночи при 37°C. Затем колонии суспендировали в бульоне Мюллера-Хинтона (МХБ), который разбавляли свежим МХБ до получения концентрации 106 КОЕ / мл. Штаммы S. pneumoniae,S. pyogenes,S. aureusиE. coli strains инокулировали на пластинки кровяного агара или МХА и инкубировали в течение ночи при 37°C, и инокулюм готовили так же, как для H. influenzae.
Чтобы определить минимальную подавляющую концентрацию эфирных масел в испарениях, проводили следующие процедуры.Чашки Петри, содержащие шоколадный агар, кровяной агар или МХА (по 10 мл в каждой), были инокулированы соответствующими тестируемыми штаммами (5 мкл, 106 КОЕ/мл) с использованием микропланшета и помещены в герметичные контейнеры емкостью 1,3 л. Внутри контейнеры были выстланы алюминиевой фольгой, чтобы защитить стенки от загрязнения трудно смываемыми эфирными маслами.
Готовили двукратные серийные разведения эфирных масел или их основных компонентов в этилацетате в концентрациях 4000, 2000, 1000, 500, 250, 125, 62.5, 31.3, 15.6 и 7.8 мг/мл. Частью раствора (260 микролитров) равномерно пропитывали фильтровальную бумагу диаметром 9 см, которую сушили в течение 1 мин для удаления этилацетата и помещали в герметичный контейнер в стороне от чашки Петри. Чтобы убедиться в отсутствии влияния растворителя, в контрольный контейнер помещали фильтровальную бумагу. пропитанную только этилацетатом и высушенную при комнатной температуре. Во втором эксперименте в герметичный контейнер помещали чистое эфирное масло в стеклянном сосуде диаметром 3 см, чтобы получить концентрации в воздухе 800, 400, 200, 100 и 50 мг/л. Этилацетат был выбран в качестве растворителя, поскольку он менее токсичен, чем растворители, содержащие соединения хлора или бензола, и достаточно летуч, чтобы быстро испаряться после высыхания при комнатной температуре. Этилацетат также применяется для экстракции эфирных масел из агара. Диэтиловый эфир, часто применяемый в прошлом, слишком летуч, чтобы обеспечить постоянный объем раствора.
Конейнеры инкубировали при 37°C в течение ночи, затем определяли МИК эфирных масел, прекращающие рост бактерий, и выражали их в мг/л воздуха. В третьем эксперименте чашки Петри вынимали из контейнера через 2 часа и инкубировали вне его в течение ночи. МИК определяли так же, как во втором эксперименте.
В боковой стенке герметичного контейнера на расстоянии 4 см выше дна было просверлено отверстие диаметром 5 мм и закрыто силиконовой пробкой, которая была зафиксирована пластиковым цементом. В контейнер помещали чашку Петри, содержащую 10 мл МХА и подогревали до 37°C в течение 1 часа. Затем туда помещали фильтровальную бумагу, пропитанную эфирным маслом в дозе, соответствующей МИК против S. pneumoniae, контейнер выдерживали при температуре 37°C, и через 0.5, 1, 2, 4 и 16 часов из него брали образцы воздуха объемом 1 мл с помощью герметичного шприца, которые сразу же вводили в герметичный сосуд с 0.5 мл этилацетата. Сосуд энергично встряхивали в течение 3 мин, чтобы растворить испарения эфирных масел. Четыре микролитра полученного экстракта анализировали методом ГХ.
Абсорбцию испарений слоем агара оценивали после экстракции этилацетатом (30 мл) в течение 3 часов при комнатной температуре, после чего образец высушивали над безводным сульфатом натрия и проводили ГХ анализ. Предварительно было установлено, что в агаре можно экстрагировать 75–92% основного компонента и что гомогенизация слоя агара не улучшает экстракцию. Количество абсорбированных соединений оценивали, принимая исходное количество на фильтровальной бумаге за 100%.
Исследования методом ГХ были проведены с помощью газового хроматографа, оснащенного колонкой DB-5 (0.5 mm × 30 m) и пламенно-ионизационным детектором. В качестве газа-носителя был выбран гелий со скоростью потока 3.8 мл/мин. Температуру колонки повышали от 60 до 160°C со скоростью 5°C/мин. Терпеновые карбоновые кислоты, которые нельзя анализировать в этих условиях, переводили в эфиры триметилсилил-карбоновых кислот, воздействуя на экстракт в этилацетате 10% раствором триметилсилилдиазометана в метаноле при комнатной температуре за 30 мин до начала анализа.
Газохромато-масс-спектрометрический анализ (ГХ/МС) был проведен с помощью газового хроматографа, соединенного с масс-спектрометром. Температуру колонки TC-5 (0.25 мм×30 м) повышали от 60 до 160°C со скоростью 5°C/мин. Хроматографические пики идентифицировали, сравнивая картины фрагментации масс-спектров и время удержания с таковыми эталонных соединений. Количественное определение компонентов проводили с помощью калибровочной кривой зависимости площади пика от концентрации чистого вешества.
Результаты
Антибактериальная активность эфирных масел и их основных компонентов при контакте с их газовой фазой
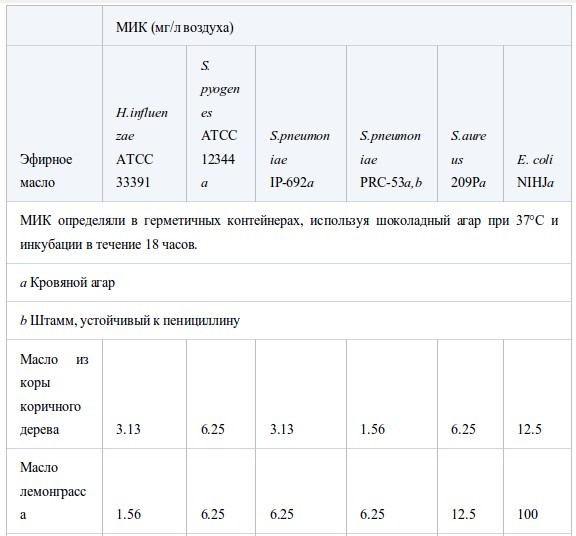
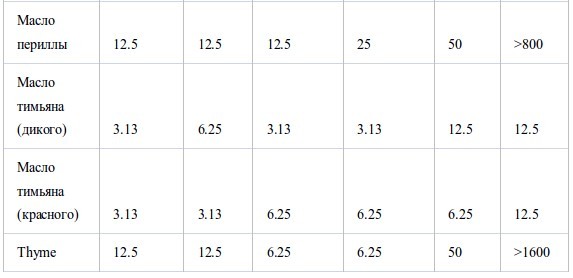
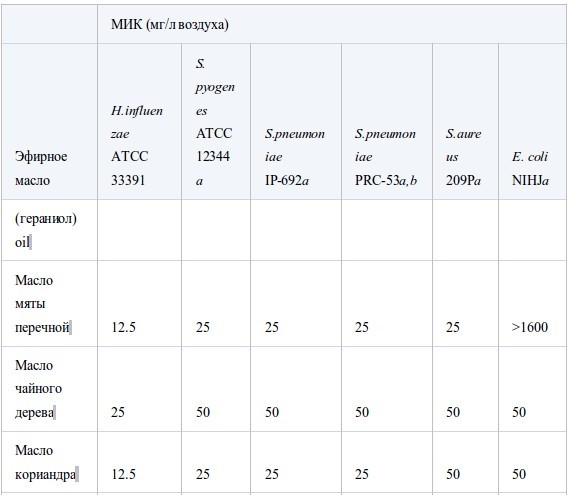
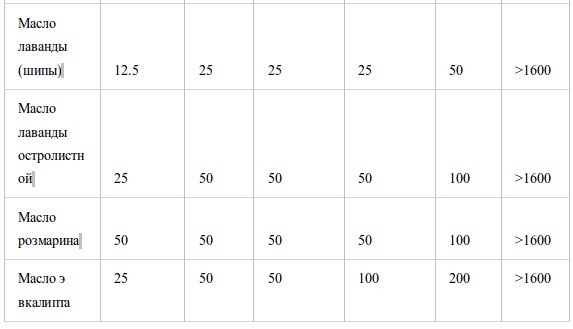
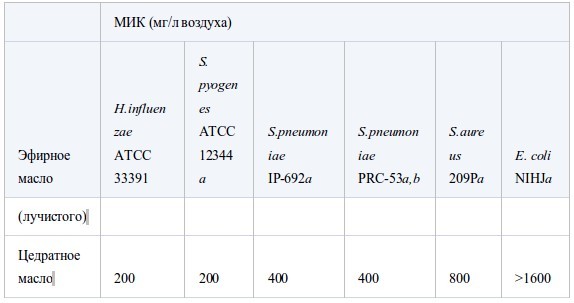
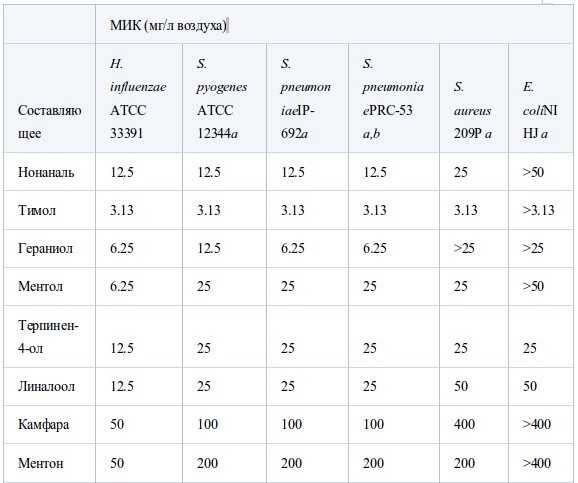
В таблице II представлены значения МИК, полученные в условиях герметичности. Все эфирные масла продемонстрировали антибактериальную активность, которая возрастала в ряду E. coli<S. aureus<стрептококки<H. influenzae. Между устойчивым и чувствительным к пенициллину штаммами S. pneumoniaeперекрестная устойчивость не была обнаружена. Также не было найдено достоверных различий в чувствительности S. pneumoniaeиS. pyogenes. Активность масел из коры коричного дерева, лемонграсса и тимьяна (дикого и красного) была наиболее высока. Они подавляли рост шести штаммов в концентрации менее 12.5 мг/л воздуха, за исключением масла лемонграсса, которое было малоактивно противE. coli(МИК 100 мг/л воздуха). Масла периллы, тимьяна (хемотип гераниол), мяты перечной, чайного дерева, кориандра и лаванды (шипов и лаванды остролистной) проявляли умеренную активность в отношении всех штаммов, за исключением E. coli. Тем не менее активность масла чайного дерева и кориандра противE. coliбыла такой же, как и против других штаммов. Наименее активны были масло эвкалипта (лучистого) и особенно цедратное масло.
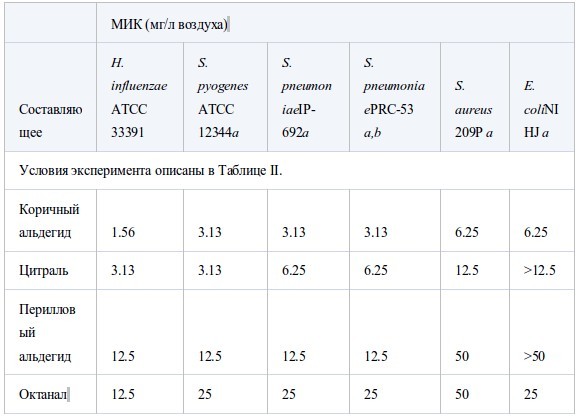
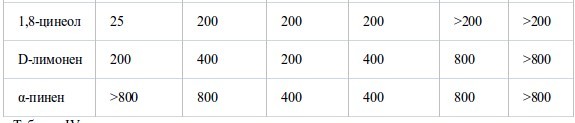
В таблице III собраны значения МИК основных компонентов и родственных соединений. МИК основных компонентов были близки к таковой исходных эфирных масел. Среди альдегидных компонентов коричный альдегид масла из коры коричного дерева был наиболее активен против шести штаммов, его МИК составляла менее 6.25 мг/л воздуха. Ему уступал цитраль, затем перилловый альдегид, октаналь и нонаналь. Активность тимола, фенольного составляющего масла тимьяна, была сравнима с таковой коричного альдегида. Среди терпеновых спиртов наиболее активен был гераниол. Ментол, терпинен-4-ол и линалоол проявляли умеренную активность примерно на одном уровне. Испытания α-терпинеола проводили только противS. aureus,его МИК достигала 25 мг/л воздуха. Активность терпеновых кетонов, ментона и камфары, так же, как терпенового эфира (1,8-цинеол) была меньше, а терпеновые углеводороды, такие, как D-лимонен и α-пинен, проявляли самую низкую активность. Активность эфирных компонентов геранилацетата и линалилацетата против S. aureus была очень слабой - 800 мг/л воздуха.
Исследование факторов, влияющих на МИК
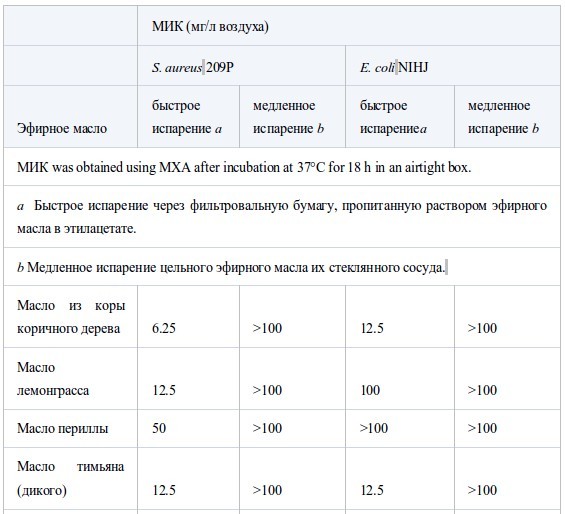
В таблице IV показано влияние скорости испарения на МИК противS. aureusиE. coli. Очевидно, что в результате быстрого испарения с фильтровальной бумаги значения МИК были ниже, чем при медленном испарении в стеклянном сосуде. Так, МИК масла коры коричного дерева составляло 6.25–12.5 мг/л воздуха при быстром испарении, но при медленном испарении торможения не наблюдали даже при концентрации 100 мг/л воздуха. У масла чайного дерева МИК при быстром испарении была в 16 раз ниже, чем при медленном. Влияние времени экспозиции на МИК было исследовано при использовании двух эфирных масел против H. influenzae. МИК масел чайного дерева и лемонграсса после 2 часов экспозиции были <50 и 3.13 мг/л, соответственно, что было эквивалентно или вдвое превышало концентрации после экспозиции в течение ночи. Для того, чтобы выяснить эффективность быстрого испарения и короткой экспозиции, исследовали динамику концентрации паров и абсорбции агаром четырех соединений. Вместо эфирного масла, состоящего из многих компонентов, для облегчение анализа полученных результатов было выбрано одно репрезентативное соединение. Когда в герметичный контейнер добавили МИК цитраля (основного компонента масла лемонграсса) для S. pneumoniae (6.25 мг/л воздуха), концентрация паров достигла максимума - 0.3 мг/л воздуха примерно через час и затем быстро понизилась. Аналогично, абсорбция слоем агара достигла максимума 215 мг/л через 1-2 часа и затем снизилась параллельно с концентрацией в парах. Так же, как у цитраля, максимальная концентрация паров тимола (основного компонена масла тимьяна) (0.1 мг/л воздуха) была достигнута через час, но затем снижалась постепенно, в отличие от цитраля. Максимум абсорбции агаром был достигнут через 2–4 ч. Динамика изменений концентрации терпинен-4-ол из чайного дерева была такой же, как у тимола, максимальная концентрация паров была 0.86 мг/л воздуха, и максимальная абсорбция агаром 1100 мг/л была достигнута через 1–2 ч. Максимальная концентрация паров D-лимонена из цедратного масла (7.4 мг/л воздуха) была достигнута через 1 ч, но в отличие от других основных компонентов, он почти не накапливался в слое агара, максимально до 4.1 мг/л. Динамика концентрации периллового альдегида в парах и агаре (МИК 12.5 мг/л воздуха) и октаналя (12.5 мг/л воздуха) была сходна с цитралем, а у 1,8-цинеола (МИК 200 мг/л воздуха) и α-пинена (400 мг/л воздуха) - с терпиненом-4-ол и D-лимоненом, соответственно.
Изменения компонентов эфирных масел, абсорбированных агаром во время инкубации
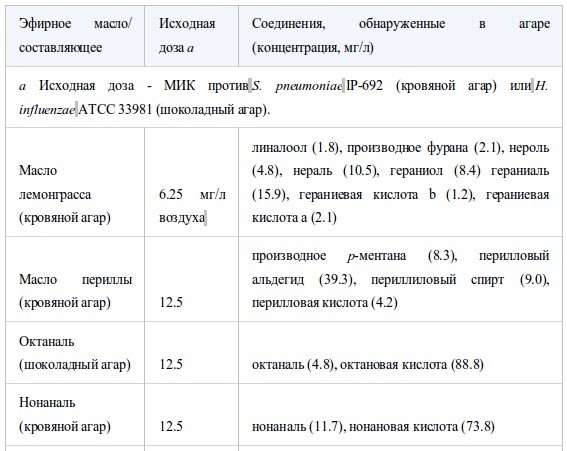
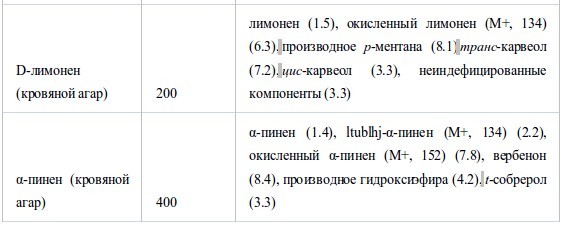
В таблице V представлен анализ компонентов пяти эфирных масел, абсорбированных на кровяном или шоколадном агаре в дозе МИК после инкубации в течение ночи. У масла лемонграсса в дополнение к исходным компонентам (нераль и гераниаль) образовались новые продукты распада - нероль, гераниол и производное фурана. Более того, при анализе триметилсилилэфира было обнаружено формирование гераниевых кислот b и a. У масла периллы заново образовались продукты восстановления (периллиловый спирт) и окисления (перилловая кислота), а также производные гексагидропарацимола.Не было обнаружено продуктов восстановления октаналя и нонаналя, преимущественно возникали продукты окисления – октановая и нонановая кислоты. Как показано в таблице V, D-лимонен и α-пинен образовали множество продуктов окисления.
Обсуждение
Поскольку до сих пор не существовало меры выраженности антимикробной активности в контакте с газовой фазой, в данном исследовании для сравнения активности испарений различных эфирных масел был предложен новый параметр, МИК. Значение МИК определяли как минимальную ингибирующую дозу на единицу площади, необходимую для подавления роста микроорганизмов в замкнутой системе. Значение МИК, выраженное в мг/л воздуха, не обязательно представляло собой фактическую концентрацию пара, которая постоянно изменялась в процессе инкубации. Максимальная концентрация паров была намного меньше, чем рассчитанная по МИК. Например, самые высокие уровни пара для цитраля, тимола, терпинен-4-ол и лимонена были от 1/17 до 1/58 от вычисленных уровней. Более низкий уровень концентрации был вызван потерями массы испарений, например, абсорбцией в среде и в камере, утечкой и иногда спонтанным разложением. Однако значение МИК было воспроизводимым, когда условия анализа были идентичными, и это позволяло сравнивать биологическую активность ряда летучих соединений.
Одним из наиболее важных результатов этого исследования было то, что величина МИК зависела от скорости испарения эфирных масел, т.е. при быстром испарении из пропитанной фильтровальной бумаги МИК была в 16 раз меньше, чем при медленном испарении цельного масла из стеклянного сосуда. В условиях быстрого испарения четыре основных компонента демонстрировали максимальную концентрацию в парах и максимальную абсорбцию агаром через 2 ч, затем концентрации постепенно или быстро уменьшались. Кроме того, воздействие паров в течение короткого промежутка времени (2 ч) дало сопоставимый или в два раза больший МИК, чем при культивировании в течение ночи. Динамика концентраций пара и агара при медленном испарении в этом исследовании не определялась, но была измерена при 27°C во время нашего исследования противогрибковой активности эфирных масел (S. Inouye, K. Uchida и H. Yamaguchi, неопубликованные данные). Согласно этим результатам, концентрация в парах летучих веществ была постоянной во время инкубации, в то время как накопление в агаре возрастало с течением времени. Это можно объяснить, если принять во внимание, что антибактериальную активность при контакте с парами, как правило, определяли по максимальной концентрации в парах и агаре на ранних стадиях инкубации, и поддержание постоянной концентрации в испарениях может быть не столь важным для осуществления антибактериальной активности.
Судя по величинам МИК, эфирные масла, содержащие в качестве основного компонента альдегид или фенол, были наиболее активны, им немного уступали масла со спиртовыми группами. С другой стороны, активность эфирных масел, содержащих в качестве основного компонента кетоновые или эфирные группы и в особенности углеводороды, были относительно низка. МИК высокоактивного масла коры коричного дерева и самого низкоактивного цедратного масла различалась в 128 раз. Кроме того, значения МИК основных компонентов и соответствующих эфирных масел мало различались, что свидетельствует о том, что активность масел обусловлена их основными компонентами, за нижеизложенными исключениями.
Масло розмарина содержит множество компонентов примерно в одинаковых пропорциях, как показано в таблице I, но по результатам сравнения МИК камфара считается самым биоактивным компонентом. Основным компонентом эвкалиптового масла по массе является 1,8-цинеол, но α-терпинеол проявляет большую биоактивность, например, против S. aureus она выше в 8 раз. В составе других эфирных масел 1,8-цинеол также не проявляет активности (15).Та же картина наблюдается в случаях масел тимьяна (хемотип гераниол) и лаванды, где основные компоненты, соответственно геранилацетат и линалилацетат, не были активным началом, в отличие от других компонентов, гераниола и линалоола. Точно так же вклад лимонена, одного из основных компонентов, в антибактериальную активность масла тимьяна (красного) может быть незначительным.
Ранее было показано, что антимикробная активность летучих компонентов обусловлена совместным действием непосредственной абсорбции паров на микрооорганизмах и непрямого воздействия среды, поглотившей испарения (16). Значительный вклад летучих компонентов, абсорбированных агаром, в этот процесс был ранее отмечен в исследованиях с E. coli(17).Поэтому измерение концентрации в агаре было важно для оценки истинного влияния паров. Абсорбция в водосодержащую среду определяется гидрофобностью, летучестью и стабильностью летучего соединения. Так, карвакрол и тимол, которые очень стабильны, умеренно растворимы в воде и почти не летучи, накапливались в слое агара в больших количествах, чем цитраль, который нестабилен и умеренно летуч. D-лимонен, который очень летуч и очень мало растворим в воде, почти не накапливался в слое агара и быстро испарялся при понижении концентрации паров. По этой причине нельзя было ожидать сильного антибактериального действия компонентов цедратного масла, абсорбированных на агаре.
Количество вещества, абсорбированного агаром, выражали с помощью концентрации (мг/л), поскольку ранее были доказаны высокая подвижность и способность к диффузии терпеновых компонентов. В дополнение к оценке вклада в арнтибактериальную активность, осуществляемого через агаровую среду, концентрация агара может быть полезна для суждения об антимикробной активности терпеновых окмпонентов, которая тесно связана с их растворимостью в воде (18). Более того, терпеновые углеводороды и эфиры, концентрации которых в агаре предельно низки, скорее всего, образуют лишь небольшую зону ингибиции при исследовании диффузии в агаре из-за их низкой способности к диффузии и жидких средах.
Спонтанная деградация компонентов на воздухе протекает преимущественно в газовой фазе, но не была замечена в растворах. Так, окисление или окисление-восстановление альдегидных групп или ненасыщенных связей и перемещение связей наблюдали у октаналя, нонаналя, цитраль, периллового альдегида, D-лимонена и α-пинена. Окисление цитраля, D-лимонена и α-пинена на воздухе было ранее зарегистрировано (19-22).Судя по результатам ГХ анализа, химические изменения цитраля и периллового альдегида в течение первых двух часов были незначительными, что свидетельствует о том, что продукты деградации не способствуют повышению активности. С другой стороны, образование продуктов окисления D-лимонена и α-пинена происходило в течение 30 мин. Антибактериальная активность продуктов окисления лимонена и пинена в этом исследовании не проводилась, но, основываясь на наших ранее полученных результатах и данных литературы (23),эти терпеновые спирты могут обладать большей активностью, чем исходные углеводороды и, стало быть, могут вносить большой вклад в биоактивность. Кстати, было показано, что D-лимонен является стабильным в водном растворе (24).
Известно, что грам-положительные бактерии более чувствительны к эфирным маслам. чем грам-отрицательные (25,26). Наша данные о том, чтоE. coli была менее чувствительна к 14 эфирным маслам, согласуется с ранее полученными нами данными. Низкая антибактериальная активность эфирных масел против грам-отрицательных бактерий объясняют структурой внешней мембраны (27, 28) на которой гидрофильные цепи молекул полисахаридов образуют барьер для гидрофобных эфирных масел. Соответственно, неожиданной была высокая чувствительность H. influenzae. Одной из причин этого может быть гидрофобная природа внешней мембраныH. influenza, формирующих колонии с неровным краем, в отличие от E. coliиPseudomonasaeruginosa, формирующих колонии с гладким краем.
Отсутствие перекрестной резистентности между устойчивыми и чувствительными к пенициллину штаммами S. pneumoniaeобъясняется различными механизмами действия эфирных масел по сравнению с β-лактамными антибиотиками (29, 30).
Таким образом, можно заключить, что антимикробная активность эфирных масел в газоообразной фазе наиболее эффективна при кратковременном контакте с их парами. Судя по результатам данного исследования, эфирные масла могут подавлять рост бактериальных патогенов инфекций респираторного тракта при максимальной концентрации испарений в воздухе 0.1–0.9 мг/л. Эта концентрация немного выше, чем та, что необходима для подавления экспериментально вызванного кашля у морских свинок - 30-500 частей на миллиард (31),но зато может быть без вреда перенесена лабораторными мышами (32).Было показано накопление испарений эфирных масел в трахее мышей и крыс в условиях естественной ингаляции (33,34). Перед тем как ввести лечение парами эфирных масел в клиническую практику, в дополнение к оценке их безопасности следует исследовать такие важные факторы, как минимальное время экспозиции и бактерицидную концентрацию, необходимую для достижения эффекта.
Таблица I.
Использованные эфирные масла и их основные компоненты
Содержание каждого основного компонента определяли по площади пика относительно общей площади пика в ГХ-анализе.
Перечислены основные компоненты > 15%, за исключением эвкалиптового масла. Множественные составляющие расположены в порядке времени удерживания в ГХ.
Таблица II.
Антибактериальная активность эфирных масел при контакте в газообразной форме
Таблица III.
Антибактериальная активность основных компонентов эфирных масел и их составляющих
Таблица IV
Влияние скорости испарения на величину МИК
Table V.
Продукты окисления воздухом основных компонентов эфирных масел после инкубации в течение ночи при 37°C
ЛитератураИсточник
- Federspil, P., Wulkow, R. & Zimmermann, T. (1997). Effect of standardized Myrtol in therapy of acute sinusitis—Results of a double-blind, randomized multicenter study compared with placebos. Laryngo-Rhino-Otologie 76 23–7.
- von Schindl, R. (1972). Inhalative Wirkung aetherischer Oele. Wiener Medizinische Wochenschrift122, 591–3.
- Boyd, E. M. & Sheppard, E. P. (1970. Nutmeg oil and camphene as inhaled expectorants. Archives of Otolaryngology 92, 372–8.
- Burrow, A., Eccles, R. & Jones, A. S. (1983). The effects of camphor, eucalyptus and menthol vapors on nasal resistance to airflow and nasal sensation. Acta Otolaryngologica 96, 157–61.
- Shubina, L. P., Siurin, S. A. & Savchenko, V. M. (1990). Inhalations of essential oils in the combined treatment of patients with chronic bronchitis. Vrachebnoe Delo (Kiev)Part 5, 66–7.
- Frohlich, E. (1968). Lavender oil; review of clinical, pharmacological and bacteriological studies. Contribution to clarification of the mechanism of action. Wiener Medizinische Wochenschrift 118, 345–50.
- Maruzzella, J. C., Balter, J. & Katz, A. (1959). The action of perfume-oil vapours on fungi. American Perfumer and Aromatics 74, 21–2.
- Maruzzella, J. C. & Sicurella, N. A. (1960). Antibacterial activity of essential oil vapors. Journal of American Pharmaceutical Association, Scientific Edition 49, 692–4.
- Kienholz, M. (1959). Studies on the antibacterial action of ethereal oils. Arzneimittel-Forschung/Drug Research 9, 519–21.
- Pandey, D. K., Tripathi, N. N., Tripathi, R. D. & Dixit, S. N. (1982). Fungitoxic and phytotoxic properties of the essential oil of Hyptis suaveolens. Journal of Plant Diseases and Protection 89, 344–9.
- Gocho, S. (1991). Antibacterial action of aroma compounds in vapor state. Journal of Antibacterial and Antifungal Agents 19, 329–34.
- Inouye, S., Goi, H., Miyauchi, K., Muraki, S., Ogihara, M. & Iwanami, Y. (1983). Inhibitory effect of volatile compounds of plants on the proliferation of bacteria. Journal of Antibacterial and Antifungal Agents 11, 609–15.
- Goi, H., Inouye, S. & Iwanami, Y. (1985). Antifungal activity of powdery black mustard, powdery Wasabi (Japanese horseradish) and allyl isothioacyanate by gaseous contact. Journal of Antibacterial and Antifungal Agents 13, 199–204.
- Singh, H. B., Srivastava, M., Singh, A. B. & Srivastava, A. K. (1995). Cinnamon bark oil, a potent fungitoxicant against fungi causing respiratory tract mycoses. Allergy 50, 995–9.
- Zakarya, D., Fkih-Tetouani, S. & Hajji, F. (1993). Chemical composition–antimicrobial activity relationships of Eucalyptus essential oils. Plantes Medicinales et Phytotherapie 26, 319–33.
- Moleyar, V. & Narasimham, P. (1986). Antifungal activity of some essential oil components. Food Microbiology 3, 331–6.
- Gocho, S. (1991). Antibacterial mechanism of aroma chemical vapors. Journal of Antibacterial and Antifungal Agents 19, 511–3.
- Knobloch, K., Pauli, A. & Iberl, B. (1989). Antibacterial and antifungal properties of essential oil components. Journal of Essential Oil Research 1, 119–28.
- Orafidiya, L. O. (1993). The effect of autooxidation of lemongrass oil on its antibacterial activity. Phytotherapy Research 7, 269–71.
- Blumann, A. & Zeitschel, O. (1913). Ein Beitrag zur Autoxydation des Terpentinoels. Chemische Berichte 46, 1178–98.
- Grosjean, D., Williams, E. L., II & Steinfeld, J. H. (1992). Atmospheric oxidation of selected terpenes and related carbonyls: gas-phase carbonyl products. Environmental Science of Technology 26, 1526–33.
- Von Schenck, G. O., Neumuller, O. A., Ohleff, G. & Schrueter, S. (1965). Zur Autoxydation des (+) Limonen. Justus Liebigs Annalen der Chemie 687, 26–39.
- Megalla, S. E., Tel-Keltawi, N. E. M. & Ross, S. A. (1990). A study of antimicrobial action of some essential oil compounds. Herba Polonica 26, 181–6.
- Inouye, S., Ishihara, H., Uchida, K. & Yamaguchi, H. (2000). Preferential percutaneous absorption of monoterpene hydrocarbons and ester of essential oils in mice placed in aroma bath and alteration of compositions of essential oils. Aroma Research 1, No. 2, 75–83.
- Farag, R. S., Daw, Z. Y., Hewedi, F. M. & El-Baroty, G. S. A. (1989). Antimicrobial activity of some Egyptian spice essential oils. Journal of Food Protection 52, 665–7.
- Smith-Palmer, A., Stewart. J. & Fyfe, L. (1998). Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Letters in Applied Microbiology 26, 118–22.
- Mann, C. M., Cox, S. D. & Markham, J. L. (2000). The outer membrane of Pseudomonas aeruginosa NCTC6749 contributes to its tolerance to the essential oil of Melaleuca alternifolia (tea tree oil). Letters in Applied Microbiology 30, 294–7.
- Tassou,, C. C. & Nychas, G. J. E. (1995). Antimicrobial activity of the essential oil of Mastic gum (Pistacia lentiscus var. chia) on gram-positive and gram-negative bacteria in broth and model food systems. International Biodeterioration &Biodegradation 36, 411–20.
- Onawunni, G. O. & Ogunlana, E. O. (1985). Effect of lemongrass oil on the cells and spheroplasts of Escherichia coli NCTC 9001. Microbios Letters 28, 63–8.
- Savino, A., Lollini, M. N. & Menghini, A. (1994). Antimicrobial activity of the essential oil of Pneumus boldus (bold). Aromatogram and electron microscopy observations. Bollettino di Microbiology e Indagini di Laboratorio 14, 5–12.
- Laude, E. A., Morice, A. H. & Grattan, T. J. (1994). The antitussive effects of menthol, camphor and cineole in conscious guinea pigs. Pulmonary Pharmacology 7, 179–84.
- Inouye, S. & Yamaguchi, H. (2001). In vivo absorption and safety evaluation of essential oils in mice by continuous vapor contact for a week. Aroma Research 2, No. 1, 66–70.
- Inouye, S. & Yamaguchi, H. (2000). Systemic absorption of essential oils in mice by holistic vapor exposure. Aroma Research 1, No. 3, 72–9
- Inouye, S. & Yamaguchi, H. (2000). Systemic absorption and metabolism of essential oils in rats by holistic vapor exposure. Aroma Research1, No. 4, 77–81.
Опубликовано:InouyeS., TakizawaT., YamaguchiH. J. Antimicrob. Chemother. (2001) 47 (5): 565-573.
Перевод и редактирование: Г.Б.Большакова





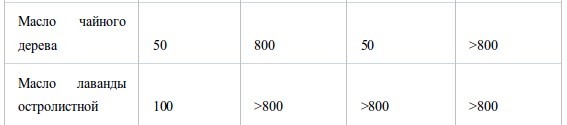


 Ответить с цитированием
Ответить с цитированием







